Relyvrio 停产:顶级替代品以及如何继续治疗
最后更新2024 年 5 月 14 日

即使新药在您的国家未获批准,您也可以合法获取。
如何学习Relyvrio 于 2022 年获得美国食品及药物管理局的加速批准,为美国的 ALS 患者带来了一线希望。然而,这种药物的火花并没有持续太久。在两次被拒后,EMA 的批准 从未到来。2024 年 3 月,PHOENIX 试验结果未能证明 Relyvrio 在更多人群中的疗效1。
Relyvrio 的停产似乎不可避免。然而,美国有 4000 多名患者正在接受这种治疗,全球可能还有更多的患者通过 "命名患者导入 "获得了这种治疗。
如果您是其中一员,那么以下是您应该了解的有关 Relyvrio 临床试验失败的情况以及您的替代方案。
Relyvrio 临床试验失败:发生了什么?
当 Relyvrio 在美国获得加速批准时,美国食品及药物管理局确实指出,没有足够的证据表明这种药物有助于延长 ALS 患者的生存期或减缓疾病的进展6。然而,当时(现在仍然)有明显的治疗需求未得到满足。因此,FDA 决定继续审批,而不是等待 PHOENIX 3 期试验的结果。
时间快进到 2024 年初,PHOENIX 试验的结果却让人大跌眼镜。经过48周的治疗后,Relyvrio与安慰剂相比没有显示出明显的疗效。临床疗效是通过 ALS 功能评定量表-修订版(ALSFRS-R)1 分的变化来衡量的。
在其他次要结果方面,Relyvrio 与安慰剂相比也没有统计学意义上的明显优势。这些结果包括缓慢生命体征能力下降、生活质量、King's 和米兰-托里诺分期下降、无通气生存率和长期生存率2。
这些结果令许多医生和患者大吃一惊。特别是考虑到Centaur试验的结果,与安慰剂相比,Relyvrio减缓了ALSFRS-R评分的下降,尤其是在精细运动技能方面。接受 Relyvrio 治疗的患者死亡风险降低了 44%,中位生存期为 25 个月,而对照组仅为 18.5 个月。24 个月后,Relyvrio 患者的存活率为 51.6%,而安慰剂组为 33.9% 7。
然而,数据就是数据。接下来会发生什么?
Relyvrio 是否将退出市场?
是的。2024 年 4 月 4 日,Relyvrio 的制造商 Amylyx 公司宣布,已启动 Relyvrio 退出市场的程序3。Relyvrio 的撤销将适用于美国和加拿大这两个已批准上市的市场。根据Amylyx公司的新闻稿,目前正在服用Relyvrio并希望继续治疗的患者将转入免费治疗项目3。
如果您受到 Relyvrio 下架的影响,以下是您的一些选择和替代方案。
您有哪些 Relyvrio 替代品?
如果您或您所爱的人一直在服用 Relyvrio,那么临床试验失败的消息一定会让您难以接受。尤其是如果您曾服用过该药物并取得了良好的效果。
不过,您也可以采取一些措施。所有这些都需要与主治医生进行讨论。
继续通过制造商访问 Relyvrio
如果您对 Relyvrio 治疗感到满意,而且医生希望您继续接受治疗,您可以联系 Amylyx,加入他们的免费计划。这对您来说可能是最好的选择,而且也不会产生任何经济后果。
遗憾的是,如果您在尚未批准的国家服用 Relyvrio(通过"指定患者进口 "条例),免费计划可能对您不适用。您必须向Amylyx公司咨询,并与公司讨论您的个人情况。
如果您不符合免费计划的条件,但又想继续服用 Relyvrio,您还可以与医生讨论另一种选择。
将 Relyvrio 替换为其成分 (Ammonaps 和 Tudca)
Relyvrio 的活性成分是sodium phenylbutyrate 和牛磺熊二醇。如果想在 Relyvrio 退市后继续治疗,您可以购买这两种活性成分并同时服用。
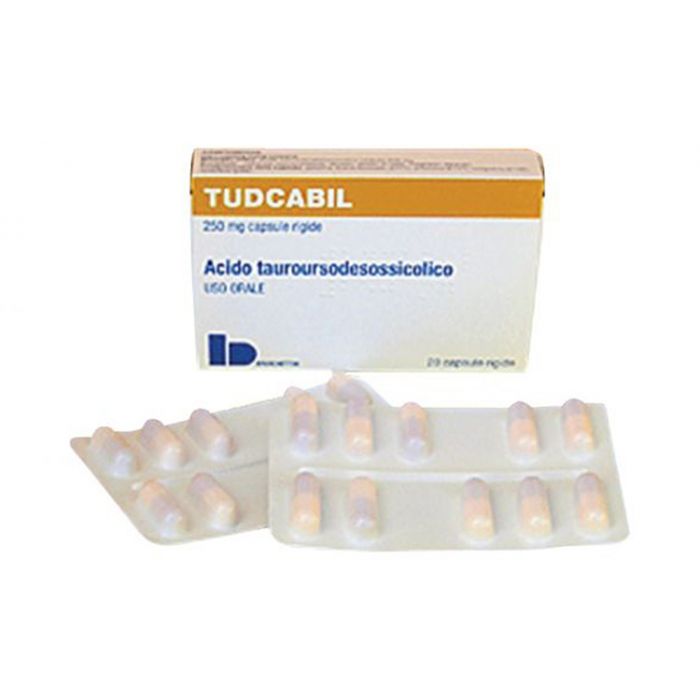
- 成分 1:Tudca。Taurursodiol(又称tauroursodeoxycholic acid )可以Tudca或Tudcabil 的名称购买。Tudca 在意大利获得批准。Tudca 目前正在进行治疗 ALS 的临床试验,并已获得 EMA 指定的孤儿药资格。如需在意大利境外订购 Tudca,请通过Everyone.org 与我们的团队联系。我们将帮助您以指定患者的身份购买和进口该药物。
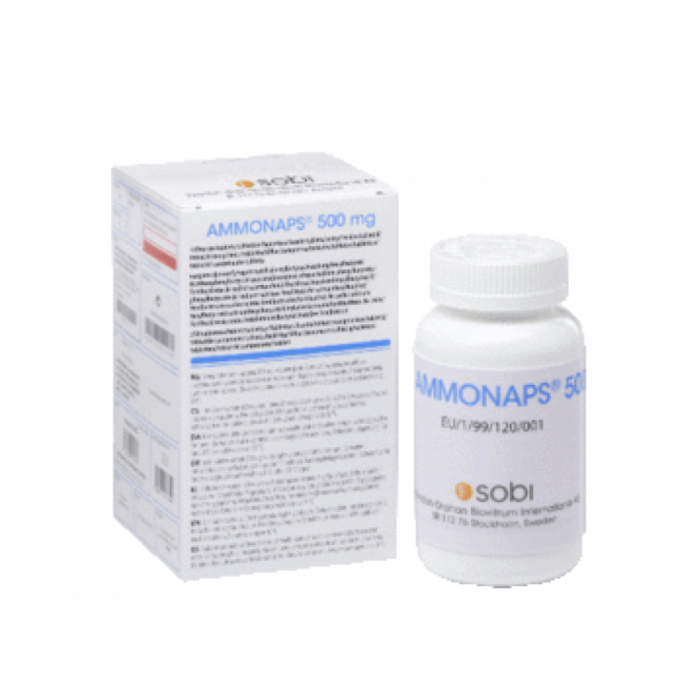
- 成分 #2:Ammonaps.Sodium phenylbutyrate 可以购买,名称为 Ammonaps.它已获得欧洲药物管理局(EMA)和美国食品和药物管理局(FDA)批准,用于治疗尿素循环障碍。但它并没有在任何地方被批准用于治疗 ALS。但是,您的医生可以将其与 "图卡 "联合用于这一适应症(称为标签外处方)。如果您有处方,无论您在哪里,我们都可以帮助您获得药物。
其他 Relyvrio 替代品
如果您还没有开始 Relyvrio 治疗,或者没有得到您想要的结果,您就必须探索其他替代方案。以下是一些可供选择的方案,供您与医生讨论。
-
edaravone
这种药物也被称为 Radicava 或Radicut ,已获得美国食品及药物管理局批准用于治疗 ALS。虽然edaravone 还没有获得 EMA 批准,但您可以通过 "命名患者导入 "从任何地方获取它。不过,您需要医生的处方。
edaravone 旨在延缓 ALS 的进展。日本的临床研究表明,与服用安慰剂的患者相比,接受edaravone 治疗的患者功能衰退的速度较慢4。
然而,一些荟萃分析发现,接受edaravone 治疗的患者与对照组患者在功能能力评分方面的差异在统计学上并不显著5。关于生存结果,最近的一项荟萃分析报告称,接受edaravone 治疗的 ALS 患者的生存率与服用安慰剂的患者相比在统计学上有显著提高5。
这种药物是否适合您,要由您的医生来决定。
-
Rilutek (riluzole)
Rilutek (riluzole) 自 1995 年起就被 FDA 批准用于治疗 ALS。它通过调节谷氨酸的释放发挥作用,谷氨酸是一种神经递质,被认为在渐冻症的神经变性中发挥了作用。通过降低谷氨酸水平,Rilutek ,从而达到减缓疾病进展的目的。
Rilutek 在全球范围内广泛使用。但是,如果您所在的国家没有批准或供应这种药物,您也可以通过 "指定患者进口 "获取这种药物。如果您有Rilutek 的处方,但在当地无法获得该药物,请与我们的团队联系。
如果您所在国家没有 Relyvrio 替代品怎么办?
ALS 患者因缺乏可供选择的治疗方案而感到沮丧(这是情有可原的)。同样令人沮丧的是,他们知道有一种选择,但却不得不等待,直到这种选择在自己的国家出现。
Everyone.org 专门帮助患者获得所需的治疗,无论治疗在哪里获得批准。如果您的医生决定更换 Relyvrio 的成分,将您转到edaravone ,或采用其他方案,请放心,您可以获得所需的治疗。
您只需与我们联系,并将处方寄给我们。我们将竭尽全力帮助您,使 Relyvrio 的停产不会影响您的治疗。
参考文献:
- AMX0035 的 PHOENIX 试验未达到终点 - 加拿大 ALS 协会。加拿大 ALS 协会,2024 年 3 月 8 日。
- Meglio, Marco.PHOENIX 3 期研究结果令人失望,Amylyx 考虑撤回 AMX0035。NeurologyLive》,2024 年 3 月 8 日。
- Cheng, Mira.ALS 药物 Relyvrio 在临床试验失败后退出市场。美国有线电视新闻网,2024 年 5 月 14 日访问。
- edaravone 对肌萎缩性脊髓侧索硬化症强迫生命容量降低患者的疗效:第19 项研究(MCI186-19)的事后分析[临床试验 NCT01492686]。NCBI,2022 年 6 月 14 日。
- edaravone 对肌萎缩性脊髓侧索硬化症患者的安全性和疗效:系统回顾和荟萃分析。神经科学》,2024 年 5 月 14 日访问。
- Novins, Olivia, et al.Relyvrio Approval:经验教训。Parexel,2024 年 5 月 14 日访问。
- Sodium Phenylbutyrate-Taurursodiol 治疗肌萎缩侧索硬化症的试验。新英格兰医学杂志》,2024 年 5 月 14 日访问。
- EU/3/17/1844 - 用于治疗肌萎缩性脊髓侧索硬化症的孤儿指定。欧洲药品管理局,2017年3月31日。



![值得关注的有希望的 ALS 治疗方法 [2024 年最新消息]](https://zh.everyone.org/media/blog/cache/336x_0/magefan_blog/ice-22122_1280.jpg)
![肌萎缩性脊髓侧索硬化症治疗的最新早期研究 [2024 更新]](https://zh.everyone.org/media/blog/cache/336x_0/magefan_blog/major-tom-agency-mgS73ggL8RU-unsplash.jpg)