没有找到合适的药物?我们可以帮助您
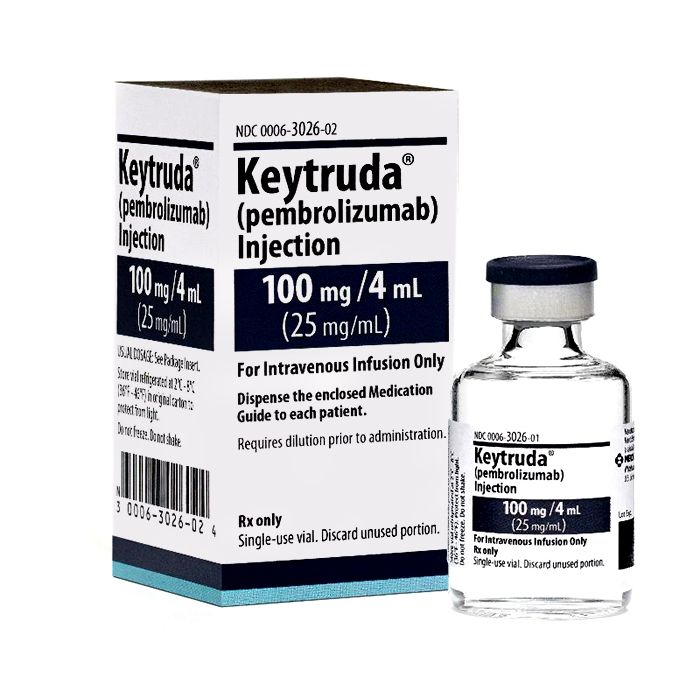
Keytruda (pembrolizumab)
Keytruda (pembrolizumab)是一种用于治疗晚期黑色素瘤、转移性非鳞状NSCLC、复发或转移性头颈部鳞状细胞癌(HNSCC)、复发的经典霍奇金淋巴瘤(cHL)。局部晚期或转移性尿路上皮癌、具有生物标志物MSI-H或dMMR的实体瘤、复发的局部晚期或转移性胃或胃食管连接处腺癌、肾细胞癌、三阴性乳腺癌。
注意:Keytruda (pembrolizumab)目前只有100mg的形式(100mg/4ml)。以前有50mg的表现形式,但从2019年3月15日起已经停产了。
疾病适应症
尿道癌、乳腺癌、大肠癌、胃癌、头颈癌、肾癌、肺癌、淋巴瘤、皮肤癌等。
制造商
默克夏普
使用方法
静脉注射
批准的药品
-
欧洲医疗机构(EMA)

-
食品和药物管理局

-
加拿大卫生部

-
治疗用品管理局(TGA)

-
Medsafe(新西兰)

帮助的病人
- 超过120万名患者得到帮助

- 帮助了11 000多名患者

- 100%成功交付到88个国家

我们可以为您提供进口文件
我们是进口法规方面的专家。滚动到下面下载您所在国家的进口指南。
常问问题
我们帮助您获得在您所在国家未获批准或未上市的已批准药品。 住处。
法律方面
我们帮助您获得在您所在国家未获批准或未上市的已批准药品。 住处。
法律方面
财务
付款方式
- 您的永久居住地在欧盟以外
- 您在购买药品后90天内未使用的情况下随身携带。
- 您有完整的收据原件(我们提供给您的
遗憾的是,在荷兰以外的合作药店送货或取货后,我们无法提供增值税退税服务。
- 如果您居住在欧盟范围内,并且您不是一个公司
- 如果您要来阿姆斯特丹、卢森堡或杜塞尔多夫取货。
在提货的情况下,如果你住在欧盟以外的地方,可能有资格申请增值税退税。
价格
偿还费用
- 您想从国外进口经批准的药品。
- The lack of reasonable treatment options available in your country (if you can, include a letter from a doctor confirming this) - no alternative to the treatment.
- 该药品已在另一个国家获得批准(请说明国家名称)。
- 您的主治医生表示此药是您的最佳选择(在给医疗保险公司的信中包括处方的副本)。
订购和运输
订购
- 患者姓名
- 患者的联系方式(电子邮件和电话号码)
- 患者的身份证复印件
- 医生的联系方式(姓名、地址、电子邮件和电话号码)
- 送货地址
- 医生的处方复印件
运输。我们可以送货到患者的住所、药房或医生办公室/医院,但这取决于国家。如果您不确定哪种选择适合您,请与我们的患者支持团队联系,我们可以帮助您解决您的具体要求。
一旦我们收到这些信息,我们的患者支持团队成员将检查您的处方,并联系您跟进您的订单。请注意,进口时可能需要其他文件,我们将指导您完成订购流程。
一般来说不会,但我们会在你付款后为你提供一张发票,你可以把发票寄给你的医疗保险公司,以便他们报销。在某些有限的情况下,我们确实接受保险。请联系我们以了解更多细节。
作为我们协议的一部分,我们可能会联系您的主治医生进行核实或信息更新。通过将您的处方发送给我们,您允许我们这样做。
- 患者的姓名和出生日期
- 药品名称及用量
- 所需数量
- 医生姓名和签名
- 医生的注册号和/或印章
理想的情况是,处方应以英文印发。或者,必须提供译文(非正式的即可)。
请注意,我们的团队成员或处理药房可能会与您的医生联系,以核实处方。
运送
由于COVID-19在全球范围内的情况和国家封锁,我们有时会出现延迟发货的情况,敬请谅解。
对于EMA批准的药品,如果处方来自申根地区,您可以到我们在阿姆斯特丹、卢森堡或杜塞尔多夫的合作药房取药。对于非EMA批准的药品,如果处方来自申根地区,您可以到我们在杜塞尔多夫的合作药房领取药品。如果您要求取药,当药品到了药房,您会收到通知。
您也可以选择将药品运送到其他国家。请与我们的患者支持团队联系,讨论其他适合您的取药和送药方式。
- 病人的身份证/护照复印件。
- 来取药者的身份证/护照复印件。
- 由病人签名的信件,说明他/她授权此人代为取药。
- 第 1 步 - 海关可能需要检查包裹以核实其内容。为了简化这一步骤,我们为海关提供了一封信,其中包含了有关内容物的信息。任何其他问题将在海关联系我们时由everyone.org 回答。
- 第2步--在一些国家,医疗监管机构(如FDA、EMA等)会提出一些额外的问题,我们会根据患者提供的信息向他们提供所有必要的资料,如:处方、身份证复印件和主治医生的信,以证明药品是个人使用。我们会根据患者提供的信息向他们提供所有必要的信息,如:处方、身份证复印件和主治医生的信,以证明药品是供个人使用的。
- 第 3 步 - 海关费用。在某些情况下,收件人将被要求支付税费。这些费用应由患者或收件人自行安排,除非另有说明,否则everyone.org 不承担这些费用。
请注意,药品的进口总是需要进口方的清关和积极配合。我们将为您提供帮助和指导,但也有赖于您的合作和响应。
关于我们
- 请在联系我们的页面上填写查询表格
- 发送电子邮件:[email protected]
- 打电话给我们
- +31 20 808 4414(欧盟)
- +1 646 381 0675 (美国)
- +61 28 417 2910(澳大利亚)
其他
现有药品
药品审批
各个国家和地区的机构,如美国的食品和药品管理局(FDA)或欧盟的欧洲医药管理局(EMA)会对这些申请进行评估,并决定是否批准新药。审查过程是基于对公司提供的证据的评估。每个机构采用的程序略有不同。
- 第一阶段--在少量健康志愿者或缺乏治疗方案的重病患者中进行,旨在研究药物对人体的影响。
- Phase II - larger number of patients, designed to evaluate the safety and efficacy of the medicine and to determine if different dosages of the treatment have different effects.
- 第三阶段--大量患者群体,旨在确认药物的安全性和有效性。
- 第四阶段--在药品获得监管部门批准后,旨在评估长期效果。
更新
财务
付款方式
- 您的永久居住地在欧盟以外
- 您在购买药品后90天内未使用的情况下随身携带。
- 您有完整的收据原件(我们提供给您的
遗憾的是,在荷兰以外的合作药店送货或取货后,我们无法提供增值税退税服务。
- 如果您居住在欧盟范围内,并且您不是一个公司
- 如果您要来阿姆斯特丹、卢森堡或杜塞尔多夫取货。
在提货的情况下,如果你住在欧盟以外的地方,可能有资格申请增值税退税。
价格
偿还费用
- 您想从国外进口经批准的药品。
- The lack of reasonable treatment options available in your country (if you can, include a letter from a doctor confirming this) - no alternative to the treatment.
- 该药品已在另一个国家获得批准(请说明国家名称)。
- 您的主治医生表示此药是您的最佳选择(在给医疗保险公司的信中包括处方的副本)。
订购和运输
订购
- 患者姓名
- 患者的联系方式(电子邮件和电话号码)
- 患者的身份证复印件
- 医生的联系方式(姓名、地址、电子邮件和电话号码)
- 送货地址
- 医生的处方复印件
运输。我们可以送货到患者的住所、药房或医生办公室/医院,但这取决于国家。如果您不确定哪种选择适合您,请与我们的患者支持团队联系,我们可以帮助您解决您的具体要求。
一旦我们收到这些信息,我们的患者支持团队成员将检查您的处方,并联系您跟进您的订单。请注意,进口时可能需要其他文件,我们将指导您完成订购流程。
一般来说不会,但我们会在你付款后为你提供一张发票,你可以把发票寄给你的医疗保险公司,以便他们报销。在某些有限的情况下,我们确实接受保险。请联系我们以了解更多细节。
作为我们协议的一部分,我们可能会联系您的主治医生进行核实或信息更新。通过将您的处方发送给我们,您允许我们这样做。
- 患者的姓名和出生日期
- 药品名称及用量
- 所需数量
- 医生姓名和签名
- 医生的注册号和/或印章
理想的情况是,处方应以英文印发。或者,必须提供译文(非正式的即可)。
请注意,我们的团队成员或处理药房可能会与您的医生联系,以核实处方。
运送
由于COVID-19在全球范围内的情况和国家封锁,我们有时会出现延迟发货的情况,敬请谅解。
对于EMA批准的药品,如果处方来自申根地区,您可以到我们在阿姆斯特丹、卢森堡或杜塞尔多夫的合作药房取药。对于非EMA批准的药品,如果处方来自申根地区,您可以到我们在杜塞尔多夫的合作药房领取药品。如果您要求取药,当药品到了药房,您会收到通知。
您也可以选择将药品运送到其他国家。请与我们的患者支持团队联系,讨论其他适合您的取药和送药方式。
- 病人的身份证/护照复印件。
- 来取药者的身份证/护照复印件。
- 由病人签名的信件,说明他/她授权此人代为取药。
- 第 1 步 - 海关可能需要检查包裹以核实其内容。为了简化这一步骤,我们为海关提供了一封信,其中包含了有关内容物的信息。任何其他问题将在海关联系我们时由everyone.org 回答。
- 第2步--在一些国家,医疗监管机构(如FDA、EMA等)会提出一些额外的问题,我们会根据患者提供的信息向他们提供所有必要的资料,如:处方、身份证复印件和主治医生的信,以证明药品是个人使用。我们会根据患者提供的信息向他们提供所有必要的信息,如:处方、身份证复印件和主治医生的信,以证明药品是供个人使用的。
- 第 3 步 - 海关费用。在某些情况下,收件人将被要求支付税费。这些费用应由患者或收件人自行安排,除非另有说明,否则everyone.org 不承担这些费用。
请注意,药品的进口总是需要进口方的清关和积极配合。我们将为您提供帮助和指导,但也有赖于您的合作和响应。
关于我们
- 请在联系我们的页面上填写查询表格
- 发送电子邮件:[email protected]
- 打电话给我们
- +31 20 808 4414(欧盟)
- +1 646 381 0675 (美国)
- +61 28 417 2910(澳大利亚)
其他
现有药品
药品审批
各个国家和地区的机构,如美国的食品和药品管理局(FDA)或欧盟的欧洲医药管理局(EMA)会对这些申请进行评估,并决定是否批准新药。审查过程是基于对公司提供的证据的评估。每个机构采用的程序略有不同。
- 第一阶段--在少量健康志愿者或缺乏治疗方案的重病患者中进行,旨在研究药物对人体的影响。
- Phase II - larger number of patients, designed to evaluate the safety and efficacy of the medicine and to determine if different dosages of the treatment have different effects.
- 第三阶段--大量患者群体,旨在确认药物的安全性和有效性。
- 第四阶段--在药品获得监管部门批准后,旨在评估长期效果。
更新
下载免费的药品进口指南。
请在下方提供您的电子邮件,以获得安全、合法地进口贵国无法获得的药品的分步指南。

让我们帮助您
如果您有任何问题或需要帮助,只需拨打一个电话,我们就能为您提供帮助。我们的团队服务时间为周一至周五上午 9 点至下午 6 点(欧洲中部时间
我们通常在 24 个工作小时内回复电子邮件
关于我们
我们是一支由药物获取专家、医生和药剂师组成的专业团队。我们来自世界各地。我们失去过家人和朋友,他们因为住错了国家而无法获得所需的药品。
我们的使命是让每个人都能在正确的时间获得正确的治疗。无论你住在哪里。因为如果有一种治疗方法可以帮助你,你就不应该遭受痛苦或死亡。
了解更多