Briumvi vsOcrevus vsKesimpta :了解多发性硬化症的治疗方案
最后更新2024 年 1 月 15 日

你可以合法地获得新药,即使它们在你的国家没有得到批准。
了解更多 "如果您正在了解多发性硬化症(MS)的治疗方法,那么 Briumvi、Ocrevus 和Kesimpta 可能会出现在您的视线中。本概述将帮助您了解这三种重要的多发性硬化症治疗方法的主要异同点。
它涵盖了从用途、作用机制、给药方法、疗效、副作用到成本和批准等各个方面。
Brumvi vsOcrevus vsKesimpta :它们是用来做什么的?
相似性
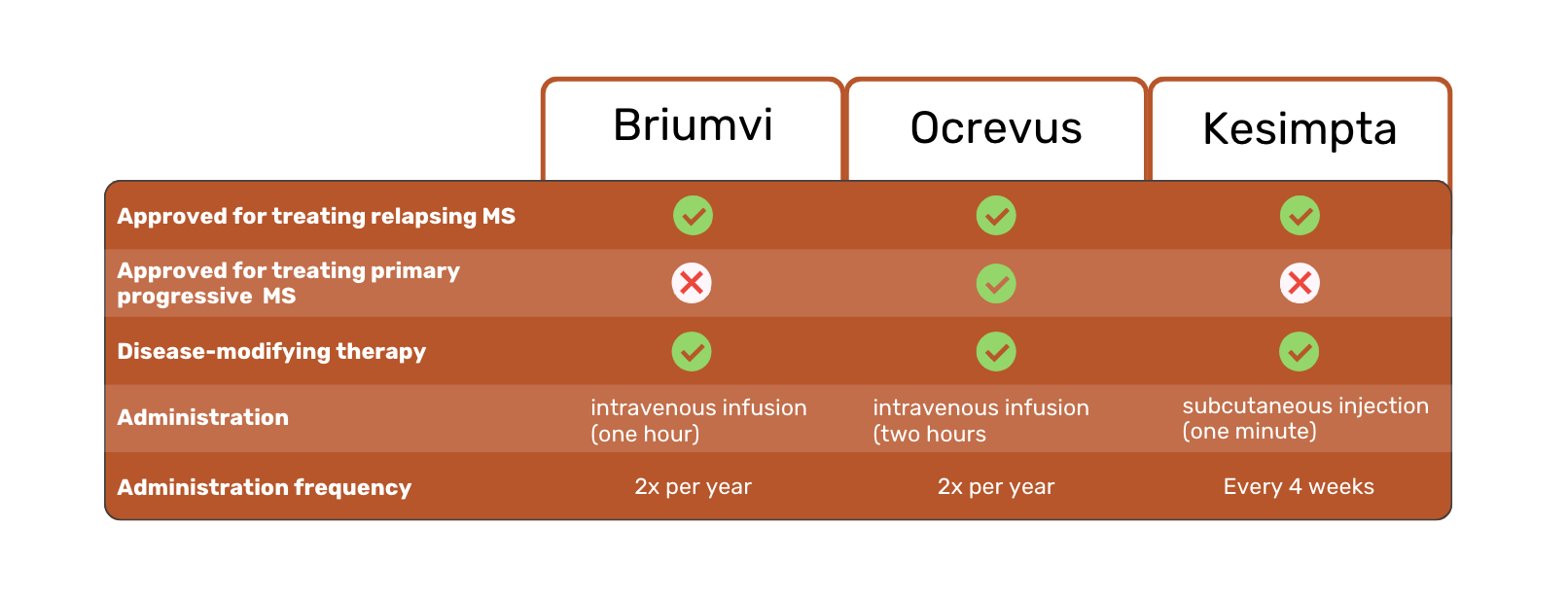
这三种疗法都是治疗多发性硬化症(MS)的处方药。更确切地说,是复发性多发性硬化症(RMS),包括临床孤立综合征、复发缓解型多发性硬化症和活动性继发性进展型多发性硬化症1,2,3。
差异
Ocrevus 是三种药物中唯一获得 FDA 批准用于治疗原发性进展性多发性硬化症(PPMS)患者的药物1。
Briumvi vsOcrevus vsKesimpta: 它们是如何工作的?
Briumvi、Ocrevus 和Kesimpta 都是改变病情的疗法。换句话说,它们的目的是减缓多发性硬化症的进展并解决其根本原因,而不是仅仅关注其症状。
这三种药物都是抗 CD20 单克隆抗体,其作用机制总体上非常相似。目前还不完全清楚它们是如何起作用的,但这三种药物都针对表达 CD20 蛋白质的特定 B 细胞。这些细胞被认为与多发性硬化症的进展有关。
通过攻击这些 B 细胞,Briumvi、Kesimpta 和Ocrevus 希望降低多发性硬化症的复发率,减缓疾病进展,并减少多发性硬化症患者脑部的活动性病变4。
如何管理 Briumvi、Ocrevus 和Kesimpta ?
这三种疗法在使用上有一些明显的不同。
Briumvi 和Ocrevus 是静脉注射。Kesimpta 则是皮肤注射。这是一个重大区别,因为它允许Kesimpta 患者在家自行注射,而不是在医院或诊所接受输液。
这三种多发性硬化症治疗方法的另一个区别在于用药频率和用药时间。Briumvi 每年需要输注两次,每次一小时。相比之下,Ocrevus 需要每年输注两次,每次两小时。Kesimpta 需要每四周注射一次。

Briumvi、Ocrevus 和Kesimpta 的效率如何?
就疗效而言,这三种药物在减少复发和减缓 RMS 病程进展方面的效果相似。以下是其临床试验结果的一些要点。
Ocrevus 临床试验结果
-
RMS 患者的研究结果
在历时两年多的两项临床试验中,Ocrevus 与另一种已获批准的多发性硬化症治疗药物 Rebif 进行了对比测试。
研究结果显示,与 Rebif 患者相比,Ocrevus 患者的复发率降低了 46%。在服用Ocrevus 的患者中,83% 的患者没有复发,而在服用 Rebif4 的患者中,71% 的患者没有复发。
在为期两年的研究中,服用Ocrevus 的患者比服用 Rebif 的患者出现残疾进展的几率低 40% 。在T1 Gd+病变方面,Ocrevus 患者的病变比 Rebif 患者少 94%。减少病变被认为是减缓多发性硬化症进展的一个重要因素4。
-
PPMS 患者的研究结果
为了评估其对 PPMS 患者的安全性和疗效,Ocrevus 与安慰剂进行了对比测试。
临床研究结果显示,在服用Ocrevus 的患者中,有 32.9% 的人出现了残疾进展,而在服用安慰剂的患者中,有 39.3% 的人出现了残疾进展。
安慰剂患者的 T2 病变体积增加了 7%,而Ocrevus 患者的 T2 病变体积减少了 3%。
Briumvi 临床试验结果
在与另一种多发性硬化症治疗药物特立氟胺(teriflunomide)的两项临床试验中,对 Briumvi 的疗效和安全性进行了测试。
临床试验结果显示,与特立氟胺患者相比,Briumvi患者的复发率分别降低了49%(试验1)和59%(试验2)。在服用 Briumvi 的患者中,86%(试验 1)和 87%(试验 2)没有复发,而特立氟胺患者的复发率分别为 74%(研究 1)和 72%(研究 2)。
与特立氟胺患者相比,Briumvi 患者的T1 Gd+ 病灶减少了 97%(试验 1 和 2)。
Kesimpta 临床试验结果
与 Briumvi 类似,Kesimpta 也在两项临床试验中与特立氟胺进行了对比测试。
结果显示,与特立氟胺患者相比,Kesimpta 患者的复发率分别降低了 51%(试验 1)和 58%(试验 2)。
与特立氟胺患者相比,Kesimpta 患者在出现残疾症状后残疾进展的可能性分别为 34%(症状出现 3 个月后)和 33%(症状出现 6 个月后)。
Kesimpta Kesimpta 患者的T1 Gd+ 病变 也分别减少了 82 %(试验 1)和 85 %(试验 2 )。


Briumvi vsOcrevus vsKesimpta :安全性和副作用
根据其处方信息,与 Briumvi、Ocrevus 和Kesimpta 治疗相关的最常见副作用大多相似。包括一些细微差别在内的概述如下。
Briumvi 的副作用
- 输液反应,包括发热、寒战、头痛、流感样症状5.
- 感染。总感染率为 56%,其中 5%为严重感染。最常见的感染是上呼吸道感染和泌尿道感染。
Ocrevus 副作用
- 输液反应,包括皮肤瘙痒、皮疹、呼吸困难、喉咙肿痛、低血压、发烧、疲倦6.
- 感染。总感染率为 58%。最常见的感染是上呼吸道和下呼吸道感染,以及皮肤感染和疱疹相关感染6。
Kesimpta 副作用
- 注射相关反应,包括肿胀、瘙痒和疼痛7.
- 感染。总感染率为 51.26%-52.7%,其中 1.8%-2.5% 为严重感染。最常见的感染是上呼吸道感染和泌尿道感染。
- 头痛
Briumvi、Kesimpta 或Ocrevus 会导致进行性多灶性白质脑病(PML)吗?
PML 是一种罕见的脑部病毒感染,通常出现在免疫力低下的人群中。Ocrevus 6 治疗后出现过一些 PML 病例。
尽管目前还没有 Briumvi 或Kesimpta 治疗后出现 PML 的病例报告,但重要的是要记住,使用任何这些疗法治疗后都可能出现 PML。
Briumvi vsOcrevus vsKesimpta :价格比较
对于尚未广泛使用的药品,费用往往因您所在的地区、供应商或保险范围而异。
以下是使用 Briumvi、Ocrevus 和Kesimpta 的年度治疗费用的近似值,假设没有保险。
没有保险的情况下,Briumvi 的费用是多少?
美国已批准 Briumvi 在市场上销售,对于美国患者来说,每年的治疗费用估计为59,000 美元。这笔费用包括两次 450 毫克的输液(共 6 瓶)。按照这个价格,Briumvi 是美国目前最经济实惠的多发性硬化症治疗药物。
不过,欧盟和美国以外其他地区的患者情况有所不同。虽然 Brumvi 已在欧盟获批,但尚未在欧盟实现商业化,因此采购成本较高。一旦 Briumvi 的欧盟定价确定,并且在当地上市,那么非美国患者的价格也可能会下降。我们看到Kesimpta 和Ocrevus 也有类似的趋势,这两种药物已在欧盟市场上销售数年。
与此同时,在美国以外的国家,单剂量 150 毫克(6 毫升)的 Briumvi 的价格约为15,130 欧元。这意味着每年的治疗费用约为90,780 欧元(6 瓶)。
Kesimpta 没有保险的费用是多少?
单剂量 20 毫克(0.4 毫升)Kesimpta ,价格约为1,700 欧元。
治疗通常从首次注射 20 毫克(0.4 毫升)开始,一周后和两周后重复注射。随后每月注射一次。
这意味着第一年的治疗费用约为25,500 欧元,之后将降至约20,400 欧元。
Ocrevus 没有保险的费用是多少?
单剂量Ocrevus (300 毫克/毫升)的价格约为8 016 欧元。
治疗通常从初始剂量 300 毫克开始,两周后重复一次。随后每 6 个月输注一次,建议剂量为 600 毫克。
第一年的治疗费用约为48096 欧元 ,之后将降至32064 欧元。


哪里批准了 Briumvi、Ocrevus 和Kesimpta ?
Briumvi 和Kesimpta 目前仅在美国和欧盟获批8、9、10、11。Ocrevus 目前在超过 98 个国家获批,包括美国、欧盟、加拿大、澳大利亚、新西兰12。
Briumvi、Ocrevus 或Kesimpta 是否(尚未)获得批准或在贵国上市?如果您和您的医生都认为这些治疗方法可能对您有益,请联系我们的医疗获取专家团队。我们可以为您提供个性化的药品采购报价。
参考文献:
- OCREVUS® (ocrelizumab) |多发性硬化症(MS)治疗。Ocrevus, Accessed 22 August 2023.
- 复发性多发性硬化症治疗 I KESIMPTA® (ofatumumab)。Kesimpta, Accessed 22 August 2023.
- BRIUMVI ®(ublituximab-xiiy)。Briumvi,2023 年 8 月 22 日访问。
- OCREVUS® (ocrelizumab) 治疗复发性多发性硬化症(RMS)的结果。Ocrevus, 2023 年 8 月 22 日访问。
- 参考编号:5101565。TG Therapeutics,2023 年 8 月 22 日访问。
- 处方信息要点。基因泰克公司,2023 年 8 月 22 日访问。
- 处方信息要点。诺华,2023 年 8 月 22 日访问。
- Briumvi | 欧洲药品管理局。欧洲药品管理局,2023 年 7 月 13 日。
- BRIUMVI™(ublituximab-xiiy)获批 | TG Therapeutics, Inc.TG Therapeutics,2022 年 12 月 28 日。
- FDA 批准 Kesimpta® (Ofatumumab),这是治疗复发性多发性硬化症的首个自控 B 细胞疗法 | MSAA。美国多发性硬化症协会,2020 年 8 月 25 日。
- Kesimpta | 欧洲药品管理局。欧洲药品管理局,2021 年 1 月 29 日。
- Ocrevus.罗氏公司,2023 年 8 月 22 日访问。
- FDA 批准 Briumvi(ublituximab-xiiy)用于复发性多发性硬化症。美国国家多发性硬化症协会,2022 年 12 月 28 日。