Lurbinectedin的 EMA 批准:即将获得批准(何时)?
最后更新2024 年 4 月 23 日

你可以合法地获得新药,即使它们在你的国家没有得到批准。
了解更多 "Lurbinectedin 被 FDA 和 EMA 指定为孤儿药。此外,它还被纳入了美国食品及药物管理局的 "奥比斯项目"(Project Orbis),以加速并发肿瘤药物的审批。这些都为各地的小细胞肺癌患者带来了希望,表明该药的审批过程有可能加快。
然而,在被指定为孤儿药 5 年多后,在加速获得 FDA 批准 3 年后,Zepzelca (lurbinectedin) 仍在等待 EMA 批准。
欧洲和英国的肺癌患者还需要等待多久才能获得这种治疗?了解最新消息,包括您在lurbinectedin 广泛应用之前的选择。
lurbinectedin 有什么用途?
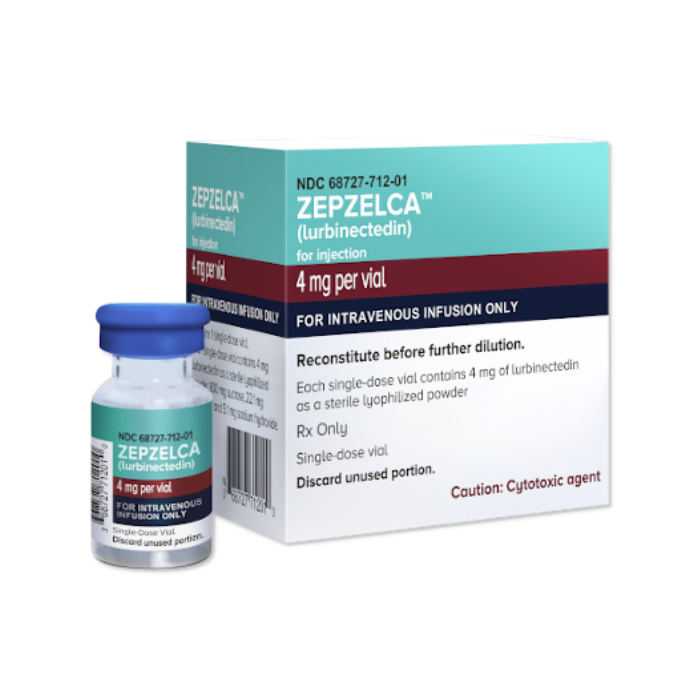
Zepzelca (lurbinectedin) 是一种治疗成人转移性小细胞肺癌(SCLC)的处方药。它专门用于化疗后病情恶化的患者。
lurbinectedin 的成功率是多少?
根据 PM1183-B-005-14 试验结果,美国食品及药物管理局加速批准了Zepzelca 。这就是报告结果对lurbinectedin 治疗 SCLC 成功率的说明:
-
35%的患者肿瘤缩小或消失;
-
中位应答持续时间为 5.3 个月;
-
最常见的不良反应包括白细胞减少、淋巴细胞减少、疲劳、贫血、中性粒细胞减少、血肌酐、丙氨酸氨基转移酶或葡萄糖1 增高。
Lurbinectedin 确证试验
为了继续获得 FDA 批准,lurbinectedin 的制造商被要求进行一项确证研究。这项名为 "ATLANTIS "的三期研究未能证明,与单纯化疗相比,该药的总生存期有明显的统计学改善。
不过,这一结果可能是研究设计造成的。例如,该研究测试的lurbinectedin 剂量低于批准的剂量,并且与化疗药物联合使用。有鉴于此,FDA 决定维持Zepzelca 的批准。为了确认其疗效,生产商必须提供设计适当的新确认试验的数据。
目前,lurbinectedin 的两项确证试验正在进行中。LAGOON 试验将于 2025 年 6 月完成,IMForte 试验将于 2026 年 3 月完成。希望这些试验的数据能为该药在美国的长期批准提供支持,并有助于加快其在欧洲等其他地区的批准速度。
Lurbinectedin的 EMA 批准:情况如何?
2019 年,EMA 授予lurbinectedin 治疗 SCLC2 的孤儿药称号。不过,自那以后,该药尚未向欧洲药品管理局提交正式的上市许可申请。
通常情况下,从提交上市许可申请到作出批准决定需要 210 天。对于孤儿药来说,这个过程可能更快一些。无论如何,即使 PharmaMar 今天提交了 EMA 批准申请,它仍有可能在 2024 年底至 2025 年初获得批准。
瑞士是这一时限的例外,该药品于 2023 年 3 月获得临时批准。
lurbinectedin 何时在欧洲上市?
这很难说。如果lurbinectedin 的 EMA 批准申请在年底前提交,理论上到 2025 年年中就会有决定。如果获得批准,Zepzelca 的 EMA 批准还需要 67 天才能正式生效。
从那时起,每个欧盟成员国都可以启动自己的本地价格谈判、报销和本地市场投放程序。这些程序需要多长时间取决于各国的情况。
德国往往是新批准的孤儿药上市最快的国家,平均 102 天即可上市。另一端是爱沙尼亚,新的孤儿药平均需要 1,081 天才能上市。
换句话说,看来lurbinectedin 在欧盟的上市时间不会早于 2025 年底或 2026 年初。
Zepzelca 何时在英国上市?
2022 年,MHRA 授予Zepzelca 创新药物称号。同年,PharmaMar 公司提交了在英国有条件上市的正式申请 5。
然而,自那时起,尚未作出任何决定。截至 2024 年 4 月,MHRA 尚未批准lurbinectedin 。NICE 也暂停了对该药可能纳入 NHS 的评估。两家机构均未提供有关决定的时间表。
如何在 MHRA 和 EMA 批准之前安全获取lurbinectedin
您是 SCLC 患者吗?如果您的医生认为您可能会从Zepzelca 的治疗中获益,您可能不需要等待该药物在欧洲或英国获得批准。相反,您的医生和您可以考虑参加lurbinectedin 临床试验。或者,以 "个人指定患者 "的方式购买这种药物。
加入lurbinectedin 临床试验
获取Zepzelca (lurbinectedin) 的方法之一是参加临床试验。这往往说起来容易做起来难,因为您和您的医生需要找到一个目前正在贵国招募参与者的试验。您还必须符合他们的资格标准。为此,您需要得到主治医生的支持。
以下是一些正在进行的lurbinectedin 临床试验的好地方:
-
ClinicalTrials.gov:这是一个包含美国所有临床试验的数据库。其中一些试验也对国际参与者开放。例如LAGOON 临床试验。该试验在美国进行,但也对欧洲和亚洲的患者开放。
-
EUClinicaltrials.eu:这是一个包含欧盟所有临床试验的数据库。目前,它所包含的2022年1月31日前启动的试验信息有限。对于这些试验,你可以参考欧盟临床试验登记册。
-
myTomorrows:这个组织支持患者在临床试验中寻找治疗方案。
购买lurbinectedin 作为指定病人
在大多数国家,允许患者购买和进口可提高生活质量或治疗危及生命的疾病的药品。如果您想在本国上市前获得Zepzelca ,这对您和您的医生来说可能是最快捷的选择。
使之成为可能的法规被称为 "个人命名的病人进口法规"。在具体的行政要求方面,各国可能存在差异。然而,在所有情况下都必须满足这些标准:
-
所涉药品在另一个国家获得了市场批准,而在病人所在的国家尚未获得批准或供应;
-
当地市场上没有替代品;
-
该药为个人使用;
-
病人有主治医生的处方信;
-
医生对治疗负责。这可能需要不同国家的文件。
在欧盟批准之前,您是否想利用《个人具名患者进口条例》获得lurbinectedin ?您首先需要咨询您的主治医生并获得合适的处方。
已有处方?我们的团队可以帮助您获取Zepzelca 。我们专门从事采购和交付在您的国家尚未上市的药品。如需了解更多信息,请与我们联系。
参考文献:
- 参考编号:4624945。Accessdata.fda.gov,2024 年 4 月 23 日访问。
- EU/3/19/2143 - 用于治疗小细胞肺癌的孤儿指定。欧洲药品管理局,2019 年 4 月 9 日。
- EFPIA 2021 年患者 W.A.I.T. 指标调查。Efpia, Accessed 23 April 2024.
- PharmaMar 宣布瑞士批准 Zepzelca® (lurbinectedin) 用于治疗转移性小细胞肺癌。Pharmamar,2024 年 4 月 23 日访问。
- PharmaMar 已申请批准lurbinectedin 在英国用于治疗转移性小细胞肺癌。Pharmamar,2024 年 4 月 23 日访问。
- 奥比斯项目。美国食品和药物管理局,2024 年 4 月 23 日访问。