Adakveo 与Oxbryta :了解您的crizanlizumab 替代品
最后更新2024 年 1 月 15 日
即使新药在您的国家未获批准,您也可以合法获取。
如何学习
Adakveo (crizanlizumab) 在欧盟的授权被撤销后,许多病人和医生需要找到Adakveo 的替代品。
如果您对治疗反应良好,即使Adakveo 不再获得欧盟批准,您仍然可以使用。但是,如果您的医生希望改变您的治疗方案,您最好了解这对您作为患者意味着什么。
在本文中,我们将探讨医生可能希望讨论的Adakveo 替代品之一 -Oxbryta (voxelotor)。在这里,您将快速了解Adakveo 和Oxbryta 的异同。
Adakveo vsOxbryta :它们有什么用途?
Adakveo 和Oxbryta 都是用于治疗镰状细胞病的处方药1,2。不过,每种药物都针对疾病的不同方面。
Adakveo Oxbryta 则用于治疗镰状细胞患者的溶血性贫血1、2。
Oxbryta 在欧盟被批准用于哪个年龄段?
Adakveo 只能用于 16 岁及以上的患者,但Oxbryta 也适用于儿童患者。
在美国,4 岁以上的儿童就可以使用Oxbryta ,而在欧盟,只有 12 岁以上的儿童才可以使用1、2。
Crizanlizumab vsVoxelotor: 它们是如何工作的?
虽然这两种药物都旨在减少镰状细胞病的并发症,但它们针对的是疾病的不同方面。
Adakveo 减少痛苦危机
Adakveo 其目的是减少畸形血细胞卡在血管中而引发的疼痛危机。
这种药物的活性成分crizanlizumab 是一种被称为单克隆抗体的特殊蛋白质。这种蛋白质能与 P-选择素结合,P-选择素是一种存在于血管内壁细胞外层的物质。
P 选择素帮助细胞粘附在血管上,并参与镰状细胞病疼痛发作时的血管阻塞。通过与 P-selectin 连接并抑制其功能,Adakveo ,以防止这些疼痛发作3。
Oxbryta 和预防贫血
Oxbryta另一方面,该方案旨在预防与镰状细胞病相关的贫血症。
Oxbryta 中的活性成分voxelotor 能增强血红蛋白保持氧气的能力,阻止血红蛋白在血管内形成僵硬的链条。这有助于红细胞保持正常的形状和灵活性。它还能降低红细胞过早破坏的速度,延长红细胞的寿命 4。
Adakveo 和Oxbryta 的效率如何?
Adakveo (crizanlizumab) 和Oxbryta (voxelotor) 的疗效已在临床试验中得到研究。
-
Adakveo 临床试验结果
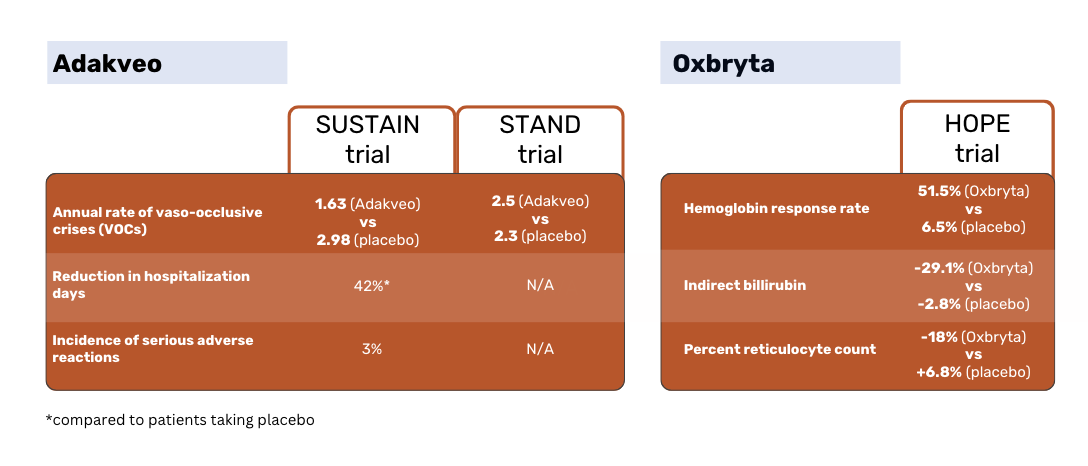
Adakveo美国食品和药物管理局的批准及其在欧盟的首次上市授权都是基于 SUSTAIN 临床研究的结果。该研究将Adakveo (含或不含水氧脲)与安慰剂进行了比较。
根据 SUSTAIN 研究结果,接受Adakveo 治疗的患者血管闭塞性危象(VOCs)的年中位数发生率明显降低,为 1.63 例,而安慰剂患者为 2.98 例。在为期 52 周的试验期间,36% 的Adakveo 患者没有出现血管闭塞危象,而安慰剂患者的这一比例为 17%1。
Adakveo STAND 试验的结果如何?
全球性的 STAND 3 期研究再次将Adakveo 与安慰剂进行了比较,结果表明,不同患者组之间的 VOC 发生率差异并不明显。接受Adakveo 治疗的患者在治疗后一年内平均出现 2.5 次疼痛危机--与安慰剂组平均 2.3 次危机没有明显差异3。
STAND 试验的结果难以令人信服,这成为Adakveo 在欧盟被撤销的依据。
-
Oxbryta 临床试验结果
在 HOPE 试验中,Oxbryta 与安慰剂进行了对比试验。疗效基于血红蛋白(Hb)应答率,即从基线到第 24 周血红蛋白增加>1 g/dL。
Oxbryta 患者的应答率为 51.1%,而安慰剂患者的应答率为 6.5%。Oxbryta 患者的间接胆红素降低了 29.1%,而安慰剂患者降低了 2.8%。Oxbryta 患者的网织红细胞百分数减少了 18%,而安慰剂患者的网织红细胞百分数增加了 6.8%2。
正如共享数据所示,由于两种药物在临床试验中采用了不同的疗效标准,因此无法对它们进行直接比较。由于这两种治疗镰状细胞病的方法不同,Oxbryta 很可能不会直接取代Adakveo ,而是医生为您制定的新治疗方案的一部分。

Adakveo vsOxbryta :安全性和副作用
根据其处方信息,这些是Adakveo 和Oxbryta 最常见的副作用:
Adakveo 副作用
- 恶心
- 关节疼痛
- 背部疼痛
- 胃痛
- Fever1.
在 SUSTAIN 试验期间,3% 的患者出现了输液相关反应,表现为头痛、发冷、呕吐、腹泻、气短或喘息等症状1。
Oxbryta 副作用
- 头痛
- 腹泻
- 胃痛
- 恶心
- 愣头青
- 发烧2
只有不到 1%的临床试验患者出现了严重的超敏反应,包括皮疹、轻度呼吸急促、轻度面部肿胀和嗜酸性粒细胞增多(白细胞数量增加)2。
Adakveo vsOxbryta :价格比较
对于尚未获得批准或尚未上市的药品,其价格仅供参考。最终价格可能因您所在的地区或供应商而异。
Adakveo 每年费用
Adakveo 的推荐剂量为每 4 周 5 毫克/千克体重。这意味着每年输注 13 次。对于一个体重 60 公斤的人来说,需要输注 13 次 x 300 毫克Adakveo ,即 39 瓶药物。
按每 100 毫升小瓶约5 214 欧元的价格计算,Adakveo ,每年的治疗费用约为 203 346 欧元。
Oxbryta 每年费用
Oxbryta 体重超过 40 千克的患者服用Oxbryta 的推荐剂量为每天一次,每次 1,500 毫克,相当于 3 片 x 每片 500 毫克。
根据上述建议剂量,一盒 90 x 500 毫克药片的价格约为 40 365 欧元,足够使用一个月。因此,Oxbryta ,每年的治疗费用共计 484 380 欧元。
Adakveo 和Oxbryta 在哪里获得批准?
Adakveo (crizanlizumab) 目前已在多个国家获得批准,包括美国、加拿大和澳大利亚7,9,10。它在欧盟的有条件销售授权已于 2023 年 5 月撤销3。
Oxbryta (voxelotor) 已在美国、欧盟和加拿大获得批准4,8,9。然而,在欧盟,Oxbryta 还未广泛上市,因为从获得授权到上市的时间因国家而异。
Adakveo 或Oxbryta 在您的国家是否已被批准或不可用?如果您和您的医生都认为这些治疗方法可能对您有益,请联系我们的药品采购专家团队。我们可以为您提供个性化的药品采购报价。
参考文献:
- 处方信息要点。诺华,2023 年 9 月 27 日访问。
- 处方信息要点。Oxbryta,2023 年 9 月 27 日访问。
- Adakveo | 欧洲药品管理局。欧洲药品管理局,2023 年 9 月 27 日访问。
- Oxbryta | 欧洲药品管理局。欧洲药品管理局,2023 年 9 月 27 日访问。
- 在线购买Adakveo (crizanlizumab)。 Everyone.org, Accessed 27 September 2023.
- 在线购买Oxbryta (voxelotor)。 Everyone.org, Accessed 27 September 2023.
- Adakveo.治疗商品管理局(TGA),2023 年 9 月 27 日访问。
- FDA 批准用于治疗儿童镰状细胞病的药物。美国食品和药物管理局,2021 年 12 月 17 日。
- 2019 年批准的新药--药品入境观察。Canada.ca,2021 年 2 月 10 日。
- FDA 批准首个靶向疗法,用于治疗镰状细胞病疼痛并发症患者。美国食品和药物管理局,2019 年 11 月 15 日。