大肠癌或结肠癌是大肠(结肠)的癌症,它是消化道的最后一部分。结肠癌和直肠癌都可以称为结直肠癌或肠癌,但根据癌症的起始部位,两者之间有一点区别。

大肠癌或结肠癌是大肠(结肠)的癌症,它是消化道的最后一部分。结肠癌和直肠癌都可以称为结直肠癌或肠癌,但根据癌症的起始部位,两者之间有一点区别。

有几种ALS药物尚未在任何国家批准,目前正在进行临床试验。阅读最新获批的治疗方法。

人表皮生长因子受体2(HER2)是所有乳腺细胞外侧的一种促生长蛋白。HER2水平高于正常水平的乳腺癌细胞称为HER2阳性。

三阴性乳腺癌(Triple-negative breast cancer,TNBC)是指孕激素和雌激素受体检测阴性,HER2蛋白过多的癌症。这意味着癌症的生长并不是由雌激素和孕激素,或者HER2蛋白来推动的。所以,TNBC对激素治疗药物或针对HER2蛋白受体的药物没有反应。

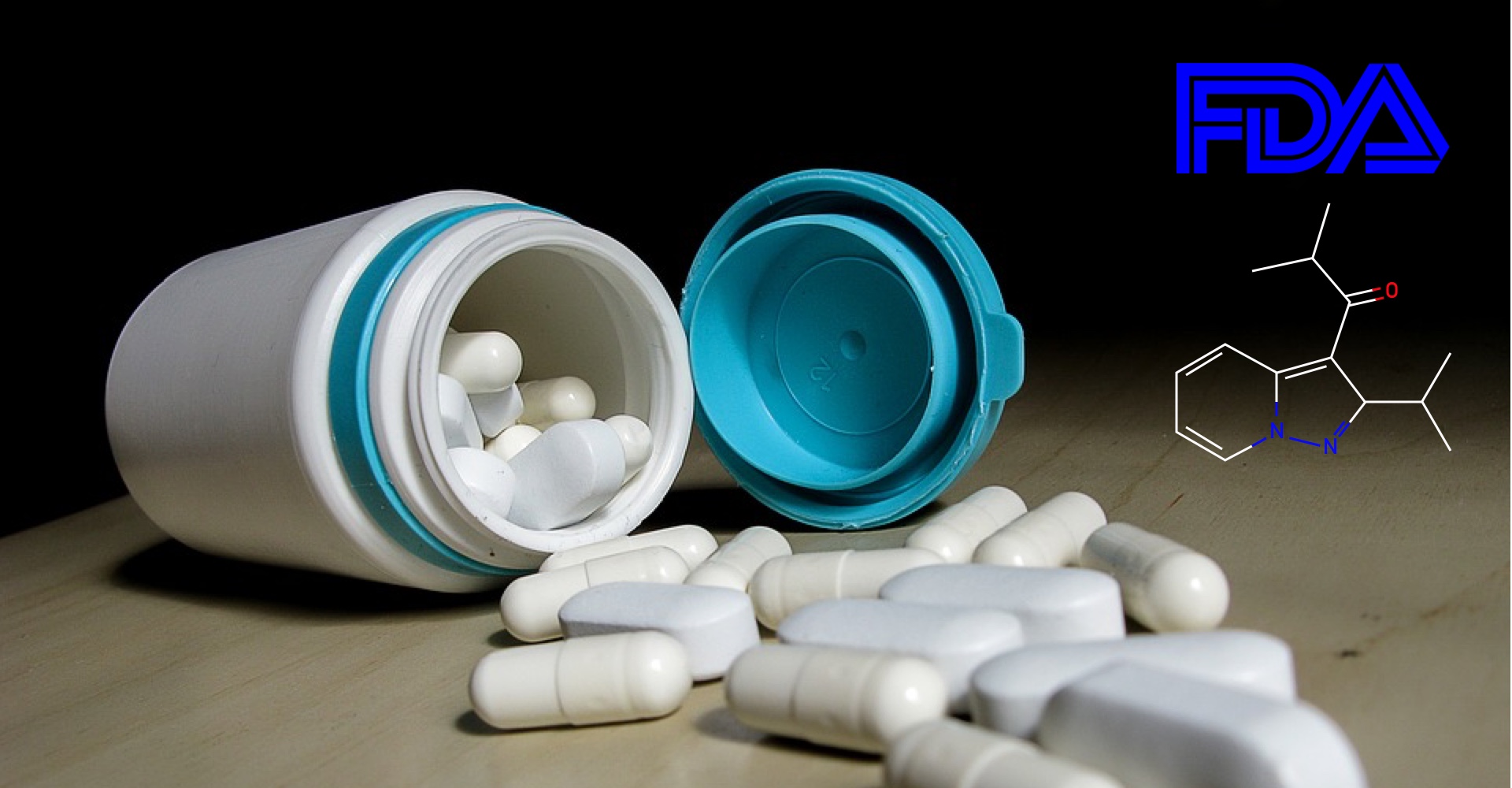
Aimovig (erenumab)是一种预防性的偏头痛治疗方法,通过阻断降钙素基因相关肽的活性而起作用,这种分子参与偏头痛的发作。

以下是每种药物的概述,以帮助您和您的医生在做出囊性纤维化的治疗决定时提供指导。 
以下是一些涉及COVID-19相关重要更新的常见问题和答案。
关于可能对ALS、帕金森病和阿尔茨海默病有用的补充剂的5个常见问题。

Biogen公司的aducanumab的新分析显示,阿尔茨海默病的临床衰退减少。
Kyowa Hakko Kirin的帕金森病疗法Nourianz (istradefylline)获得FDA批准,作为levodopa/carbidopa的附加药物。

Radicut/Radicava (edaravone),被证明可以减缓ALS的进展,现在在中国被批准用于患者。

Orkambi 和Symkevi 已经被苏格兰药品协会(SMC)拒绝,因为他们的结论是成本超过了收益。

Vitrakvi (larotrectinib) 由CHMP推荐在欧盟批准。

MN-166 (ibudilast)将作为III期临床试验的一部分,对无复发的继发性进展期多发性硬化症受试者进行试验。

欧盟现已批准用于转移性或局部晚期皮肤鳞状细胞癌成人的皮肤癌新药。

2期临床试验显示,与安慰剂相比,ibudilast 与进行性多发性硬化症患者的脑萎缩进展减缓了48%。
Vyndaqel (tafamidis)在研究表明存活率提高和因心脏相关问题导致的住院时间减少后,现已在美国获得批准。

下一阶段临床试验的批准使ALS患者离获得新的治疗方法更近了一步,新的治疗方法被证明可以减缓疾病的进展。
基于III期临床试验的可喜结果,加拿大卫生部已决定将Kalydeco (ivacaftor)的使用范围扩大到1至2岁的儿童。

最近的一项临床试验表明,Symkevi/Symdeko (tezacaftor/ivacaftor)可以安全、有效地疏通6-11岁儿童的粘稠粘液。

新的位点诊断癌症药物,Vitrakvi (larotrectinib),获得美国食品和药物管理局(FDA)的加速批准。

CHMP的评估支持EMA对非小细胞肺癌(NSCLC)药物的批准,Vizimpro (dacomitinib)。

III期试验显示,Copiktra (duvelisib)可能是复发或难治性慢性淋巴细胞白血病和小淋巴细胞淋巴瘤患者的一种选择。

Onpattro(帕替西兰)是一种减缓遗传性转甲状腺素淀粉样变性(hATTR)进展的一类治疗方法。

在未能显示出比化疗单独使用有明显的益处后,FDA和EMA均不推荐Lartruvo(olatumab)与化疗联合使用于新的STS患者。

50多个国家已经批准了Spinraza (nusinersen),但并不是所有的国家都向需要的病人提供了这种药物。

新药对前列腺癌患者有统计学意义的改善。

一种新的生物仿制药,Truxima (rituximab),显示出与参考药品利妥昔单抗(rituximab)相当的结果,并使FDA在扩大病人用药方面又向前迈进一步。

对早期FAP患者来说是个好消息;葡萄牙的一项研究结果显示,肝脏移植或Vyndaqel 可能会延长患者的生存期。

Zolgensma (onasemnogene abeparvovec-xxxx)获得FDA的优先审查,作为1型脊髓性肌肉萎缩症(SMA)的一次性治疗。
